Đề 2 - thi thử đánh giá tư duy ĐHBKHN phần Khoa học/Giải quyết vấn đề
Cập nhật lúc: 18:32 12-10-2023 Mục tin: Đề ôn luyện thi đánh giá tư duy
Xem chi tiết dưới đây đề thi thử đánh giá tư duy Bách khoa số 2 phần Tư duy Khoa học/Giải quyết vấn đề, thí sinh làm bài trong thời gian 60 phút.
NỘI DUNG BÀI THI
BIÊN SOẠN: BAN CHUYÊN MÔN TUYENSINH247.COM
Đọc bài đọc sau trả lời các câu hỏi từ câu 1 – 14:
Các electron của một nguyên tử bao quanh hạt nhân và nằm trong quỹ đạo nguyên tử. Trong các kim loại chuyển tiếp như sắt (Fe) và cobalt (Co) thì các electron lớp ngoài cùng nằm ở orbital d. Đối với một kim loại tự do, những orbital d có năng lượng bằng nhau. Tuy nhiên, ngay khi các phối tử (phân tử hoặc ion) liên kết với nguyên tử kim loại trung tâm, các electron trên orbital d (hoặc f) của ion kim loại sẽ bị phối tử đẩy và tiến hành phân tách năng lượng thành 2 mức: cao hơn so với mức năng lượng cơ bản và thấp hơn so với mức năng lượng cơ bản. Hiệu năng lượng của orbital d “cao” và orbital d “thấp” được gọi là thông số tách năng lượng (Hình 1).
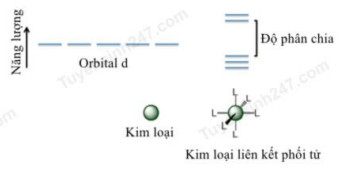
Các nhà khoa học thực hiện một số thí nghiệm để xác định sự ảnh hưởng của các yếu tố khác nhau ảnh hưởng như thế nào đến mức độ phân tách. Họ thấy rằng điện tích của ion kim loại, vị trí của kim loại trong bảng tuần hoàn (dù nó nằm ở chu kỳ 4, 5 hay 6) hay bản chất của phối tử đều là những yếu tố quan trọng. Kết quả của các nhà khoa học được tóm tắt trong Bảng 1. Lưu ý rằng giá trị của thông số tách càng lớn đồng nghĩa với việc các electron bị phân tách càng mạnh.
|
TN |
Phức chất |
Phối tử |
Hoá trị của KL |
Chu kỳ của KL |
Thông số tách (cm-1) |
|
1 |
Cr(H2O)63+ |
H2O |
+3 |
4 |
17,000 |
|
2 |
Cr(H2O)62+ |
H2O |
+2 |
4 |
14,100 |
|
3 |
Co(NH3)63+ |
NH3 |
+3 |
4 |
22,870 |
|
4 |
VF63- |
F- |
+3 |
4 |
16,100 |
|
5 |
Rh(NH3)63+ |
NH3 |
+3 |
5 |
34,100 |
|
6 |
V(H2O)63+ |
H2O |
+3 |
4 |
18,560 |
|
7 |
Ir(NH3)63+ |
NH3 |
+3 |
6 |
41,200 |
|
8 |
V(CN)63- |
CN- |
+3 |
4 |
23,850 |
Câu 1. Phát biểu nào sau đây được hỗ trợ bởi dữ liệu được trình bày trong Bảng 1?
A. Phối tử F- và NH3 gây ra sự phân tách năng lượng gần như giống nhau.
B. Phối tử H2O gây ra sự phân tách năng lượng nhỏ hơn so với F-.
C. Phối tử F- gây ra sự phân tách năng lượng lớn hơn so với CN-.
D. Phối tử CN- gây ra sự phân tách năng lượng lớn hơn so với H2O.
Câu 2. Một phức chất X(NH3)63+ chưa biết được thử nghiệm và giá trị thông số tách của nó được tìm thấy là 33,900 cm-1. Dựa vào dữ liệu Bảng 1, kim loại trong phức chất này rất có thể nằm ở chu kỳ ................
Câu 3. Xem xét Bảng 1, yếu tố nào sau đây khác nhau giữa thí nghiệm 1 và thí nghiệm 3?
A. Vị trí của kim loại trong bảng tuần hoàn.
B. Điện tích của ion kim loại trong phức chất.
C. Số lượng phối tử được thử nghiệm.
D. Phối tử được thử nghiệm.
Câu 4. Số phối trí của một phức chất đề cập đến số lượng phối tử được gắn vào nguyên tử kim loại trung tâm (tất cả các hợp chất được liệt kê trong Bảng 1 đều có số phối trí là 6). Cho rằng số phối trí thấp hơn có xu hướng gây ra sự phân tách năng lượng nhỏ hơn, giá trị nào sau đây có thể là thông số tách của Cr(H2O)42+?
A. 16,000 cm-1.
B. 12,000 cm-1.
C. 21,000 cm-1.
D. 14,500 cm-1.
Câu 5. Phát biểu sau đây đúng hay sai? Nếu thay Fe hoặc Co bằng kim loại nhóm IA thì vẫn cho hiện tượng phân tách tương tự
Câu 6. Cr, V, H2O, NH3, càng lớn, càng nhỏ
Với kim loại ............ khi cùng kết hợp với một phối tử ..............., kim loại có hoá trị ............ thì sự phân tách càng lớn
Câu 7. Phức chất của kim loại nào có sự phân tách năng lượng bị ảnh hưởng bởi yếu tố phối tử?
A. Cr.
B. Co.
C. V.
D. Rb.
Đọc bài đọc sau trả lời các câu hỏi từ câu 8 – 15:
Ở dạng tinh chế, sắt là một kim loại sáng bóng, màu xám bạc; tuy nhiên, khi sắt tinh chế tiếp xúc với điều kiện khí quyển trong một thời gian dài, bề mặt của nó trở nên bong tróc, rỗ và có màu đỏ hoặc cam. Quá trình này được gọi là " sự rỉ sét" và chất bong tróc, màu cam hoặc đỏ mới được gọi là "rỉ sét".
Dưới đây, hai nhà khoa học thảo luận về cách hình thành rỉ sét và thành phần của rỉ sét.
Nhà khoa học 1:
Cả nước và oxygen đều cần thiết để hình thành rỉ sét. Nước là môi trường điện li, có nghĩa là nó cho phép các ion di chuyển bên trong nó. Trong môi trường tự nhiên, khi một số vật liệu bằng sắt tiếp xúc với nước, nó sẽ phân ly thành ion sắt (Fe2+) và các electron tự do. Ngoài ra, khi oxygen trong khí quyển (O2) hòa tan trong nước, một số phân tử O2 phản ứng với nước để tạo thành các ion hydroxide (OH-). Vì trong nước các ion được di chuyển tự do, ion sắt và ion hydroxide kết hợp với nhau để tạo thành một hợp chất mới: hydroxide sắt. Tuy nhiên, sắt hydroxide không phải là một hợp chất ổn định. Theo thời gian, khi nước bay hơi, nó chuyển thành dạng oxide sắt ngậm nước. Đây là “rỉ sét”.
Muối có thể đóng vai trò là chất xúc tác cho sự hình thành rỉ sét, nghĩa là chúng làm tăng tốc độ hình thành rỉ sét. Tuy nhiên, rỉ sét có thể hình thành trong nước tinh khiết, trong trường hợp không thêm muối.
Tăng nhiệt độ môi trường làm tăng tốc độ hình thành rỉ sét. Ngoài ra, việc tăng diện tích bề mặt sắt tiếp xúc với nước cũng làm tăng tốc độ hình thành rỉ sét. Tuy nhiên, vì bản thân lớp rỉ sét là một lớp xốp và rỗng sẽ tạo điều kiện cho nước và oxygen có thể vào sâu bên trong cấu trúc của miếng sắt để tiếp tục quá trình tạo rỉ sét.
Nhà khoa học 2:
Sự tấn công của acid gây ra rỉ sét. Trong nước, acid ion hóa để tạo ra các ion H+ tích điện dương và các anion tích điện âm. Các ion H+ thiếu điện tử; vì điều này, chúng thu hút các electron từ sắt. Điều này tạo ra các ion sắt (Fe2+), hòa tan trong nước. Sau khi hòa tan trong nước, các ion sắt phản ứng với oxygen hòa tan trong khí quyển (O2) để tạo ra oxide sắt hoặc rỉ sét.
Acid có thể đến từ nhiều nguồn khác nhau. Ví dụ, khi carbon dioxide trong khí quyển hòa tan trong nước, acid carbonic (H2CO3) được tạo ra. Acid carbonic là nguyên nhân phổ biến nhất của rỉ sét. Tuy nhiên cũng tồn tại các nguồn acid môi trường khác như nước mưa, thường có tính acid nhẹ vì nó đã hoà tan sulfur dioxide (SO2) và nitrogen oxide (NxOy), tạo ra acid tương ứng. Ngoài ra, bản thân sắt có thể chứa các tạp chất như phosphor (P) và lưu huỳnh, cũng phản ứng với nước để tạo ra acid. Như vậy, cả môi trường acid và các tạp chất trong sắt đều là điều kiện khiến sắt bị gỉ.
Có thể ngăn ngừa rỉ sét bằng cách sơn bảo vệ bề mặt sắt để ngăn sắt tiếp xúc với nước, oxygen và acid. Sắt cũng có thể được bảo vệ thông qua biện pháp "mạ kẽm", bao gồm việc phủ lên sắt một lớp kẽm mỏng. Vì kẽm hoạt động mạnh hơn sắt nên nó bị ăn mòn trong khi sắt được bảo vệ.
Câu 8. Một chiếc đinh sắt được đặt trong một bình nước đã được đun sôi để giải phóng hết oxi hòa tan. Bình được gắn vào một máy bơm chân không để loại bỏ không khí bên trong nó. Sau đó, bình được niêm phong. Giả sử lời giải thích của Nhà khoa học 1 là đúng, kết quả nào sau đây sẽ được quan sát?
A. Oxide sắt ngậm nước sẽ hình thành trên bề mặt của đinh sắt.
B. Không có oxide sắt ngậm nước sẽ hình thành trên bề mặt của đinh sắt.
C. Oxygen sẽ tích tụ bên trong bình.
D. Các ion hydroxide sẽ được tạo ra trong dung dịch.
Câu 9. Cho rằng tất cả những điều sau đây đều đúng, điều nào sau đây, nếu được tìm thấy, cung cấp bằng chứng mạnh nhất chống lại giả thuyết của Nhà khoa học 1?
A. Khi nồng độ của các ion hydroxide trong dung dịch tăng lên, gỉ sắt hình thành ít nhanh hơn trong dung dịch.
B. Khi muối ăn được hòa tan trong nước, nước có khả năng dẫn điện tốt hơn.
C. Khi hòa tan muối ăn trong nước, tốc độ tạo ra ion Fe2+ tăng lên.
D. Trong trường hợp không có nước lỏng, sắt không bị gỉ.
Câu 10. Cho rằng tất cả những điều sau đây đều đúng, điều nào sau đây, nếu được tìm thấy, cung cấp bằng chứng mạnh nhất chống lại giả thuyết của Nhà khoa học 2?
A. Khi một miếng sắt rỉ sét được ngâm trong nước cốt chanh (acid citric), nó sẽ sáng bóng trở lại.
B. Khi một chiếc đinh sắt được ngâm trong nước trong một thùng chứa mở, rỉ sét sẽ hình thành trên chiếc đinh ngay cả khi không thêm acid.
C. Khi hai chiếc đinh sắt được ngâm trong dung dịch acid và nước giống hệt nhau, chúng sẽ bị gỉ với tốc độ khác nhau.
D. Khi không cho oxi hòa tan vào dung dịch chứa miếng sắt thì miếng sắt không bị gỉ.
Câu 11. Sodium hydroxide (NaOH) là một base trung hòa acid. Giả sử rằng dung dịch kiềm được thêm vào nước có nhúng một ống sắt. Theo Nhà khoa học 2, tốc độ rỉ sét của đường ống rất có thể sẽ …
Câu 12. Theo Nhà khoa học 1, điều kiện nào sau đây sẽ dẫn đến sự hình thành rỉ chậm nhất?
A. Cho một thanh sắt vào nước ở 30°C.
B. Cho bột sắt vào nước ở 5°C.
C. Cho một thanh sắt vào nước ở 5°C.
D. Cho bột sắt vào nước ở 30°C và thêm muối ăn.
🔥 2K9 CHÚ Ý! LUYỆN THI TN THPT - ĐÁNH GIÁ NĂNG LỰC - ĐÁNH GIÁ TƯ DUY!
- Em muốn xuất phát sớm ôn luyện ĐGNL/ĐGTD nhưng chưa biết bắt đầu từ đâu?
- Em muốn ôn thi TN THPT và ĐGNL/ĐGTD để tăng cơ hội xét tuyển nhưng không biết ôn thế nào, sợ quá tải?
- Em muốn được luyện đề chất lượng, chuẩn cấu trúc các kì thi?
- Em muốn ôn thi cùng TOP thầy cô giỏi hàng đầu cả nước?
️🎯 LỘ TRÌNH SUN 2027 - LUYỆN THI TN THPT - ĐGNL - ĐGTD (3IN1)
- Cá nhân hoá lộ trình học: Bổ sung kiến thức nền tảng/ Luyện thi/ Luyện đề phù hợp với mục tiêu và mức học lực hiện tại.
- Top thầy cô nổi tiếng cả nước hơn 15 năm kinh nghiệm
- Ưu đãi học phí lên tới 50%. Xem ngay - TẠI ĐÂY
Các bài khác cùng chuyên mục
- Đề thi thử ĐGTD Đại học Bách khoa Hà Nội - Tư duy đọc hiểu 2025 (đề 2)(07/05)
- Đề thi thử phần Tư duy đọc hiểu - Đánh giá tư duy ĐHBKHN 2025(29/04)
- Đề 6 - thi thử đánh giá tư duy ĐH Bách khoa Hà Nội có đáp án (Tuyensinh247)(29/12)
- Đề thi thử đánh giá tư duy số 4 - Phần Khoa học/giải quyết vấn đề(16/11)
- Đề thi thử đánh giá tư duy ĐHBKHN số 5 - Tuyensinh247 (có đáp án)(15/11)
- Đề 5 - ôn thi đánh giá tư duy ĐH Bách khoa Hà Nội phần đọc hiểu(17/10)
- Đề thi thử đánh giá tư duy ĐHBK Hà Nội - Phần Khoa học/Giải quyết vấn đề (số 3)(14/10)
- Đề thi thử đánh giá tư duy phần Khoa học/giải quyết vấn đề - Đề số 1(10/10)
- Đề ôn thi đánh giá tư duy ĐHBKHN (số 4) - phần Tư duy đọc hiểu(04/10)
- Đề ôn thi đánh giá tư duy Bách khoa số 3 - Phần Tư duy đọc hiểu(02/10)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi thử ĐGTD Đại học Bách khoa Hà Nội...
- Đề thi thử phần Tư duy đọc hiểu - Đánh...
- Đề 6 - thi thử đánh giá tư duy ĐH...
- Đề thi thử đánh giá tư duy số 4 -...
- Đề thi thử đánh giá tư duy ĐHBKHN số 5...
- Đề 5 - ôn thi đánh giá tư duy ĐH...
- Đề thi thử đánh giá tư duy ĐHBK Hà Nội...
- Đề 2 - thi thử đánh giá tư duy ĐHBKHN...
- Đề thi thử đánh giá tư duy phần Khoa học/giải...
- Đề ôn thi đánh giá tư duy ĐHBKHN (số 4)...
Tuyển tập đề thi đánh giá tư duy mới nhất, đề ôn luyện thi đánh giá tư duy tất cả các phần


